Details
BlueStar PLUS Prestained Protein Marker
Der BlueStar PLUS Prestained Protein Marker ist ein dreifarbiger Protein Marker mit 12 verschiedenen Proteinbanden. Die Proteinbanden erstrecken sich über einen sehr großen Molekulargewichtsbereich von 10 – 240 kDa. Der BlueStar PLUS Prestained Protein Marker eignet sich zur Beobachtung der Proteinauftrennung während der SDS-PAGE, zum Nachweis der Western-Blot Transfereffektivität bei verschiedenen Membranen (PVDF, Nylon oder Nitrocellulose) und für die Abschätzung des Molekulargewichts von Proteinen. Der Marker wird bereits in einem Ladepuffer geliefert und ist somit direkt gebrauchsfertig.
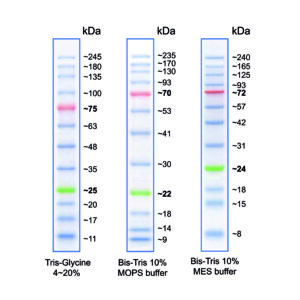
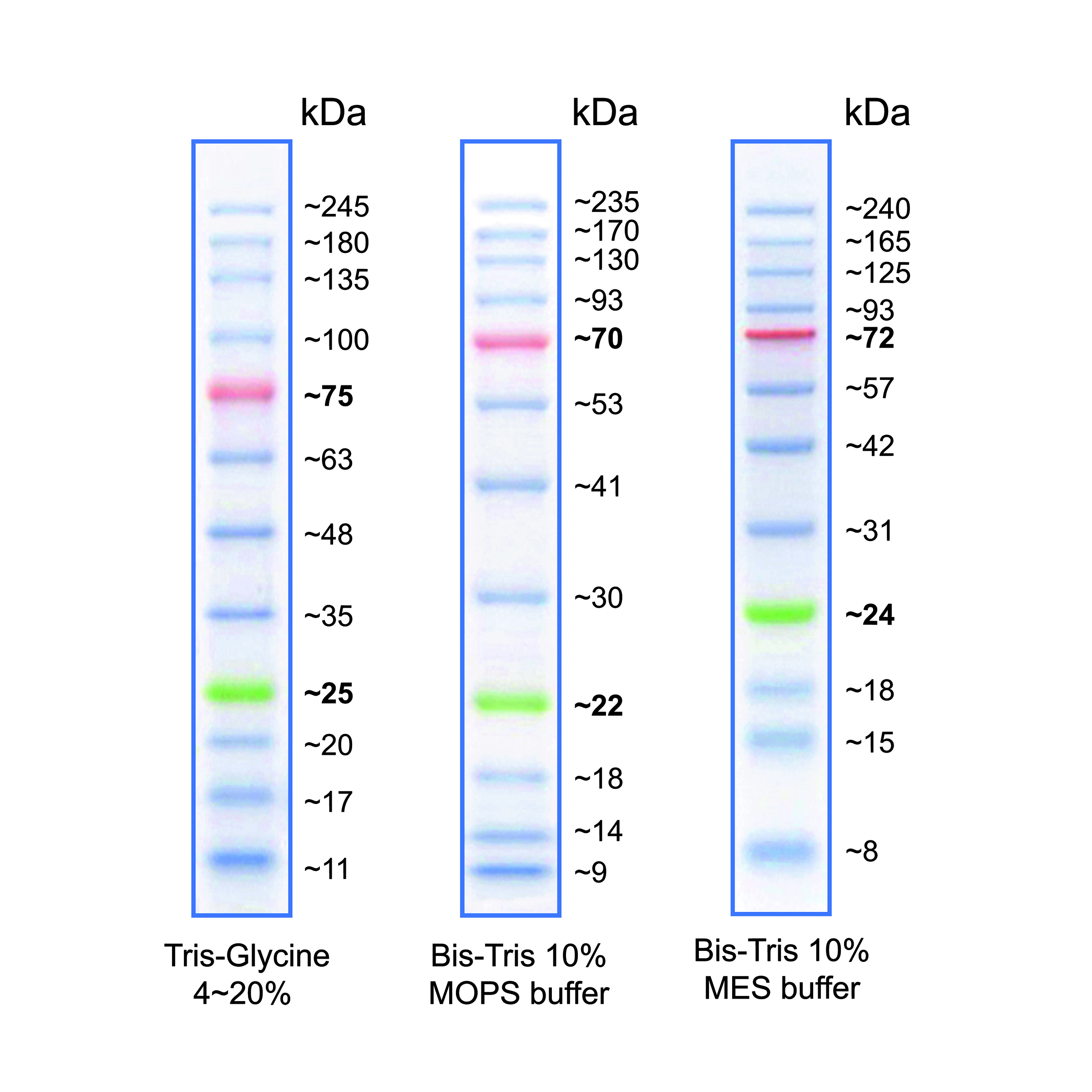
Abbildung 1: Molekulargewicht der Markerbanden bei Verwendung verschiedener Puffersysteme.
Das Molekulargewicht der Markerbanden kann je nach verwendetem Gel-/ Puffersystem variieren. Grund dafür sind Faktoren des Gel-/ Puffersystems, die das Laufverhalten von Proteinen beeinflussen, wie z.B., Migrationsrate, Gelzusammensetzung, pH-Wert (weitere Informationen siehe FAQs).
- Umfassender Größenbereich: 10 – 240 kDa
- 12 Banden mit 3 Farben (blau, rot und grün)
- Ready-to-use: Integrierter Ladepuffer für eine direkte Beladung des Gels
- Referenzbanden bei 25 kDa (grün) und 75 kDa (orange)
- Scharfe Banden
Inhaltsstoffe
Pro Bande sind etwa 0,1 – 0,4 mg/mL Protein in Pufferlösung enthalten. Die Pufferlösung ist wie folgt zusammengesetzt: 0,2 mM Trisphosphat, pH 7,5 bei 25 °C, 2 % SDS, 10 mM Dithiothreitol, 3,6 M Urea, und 15 % (v/v) Glycerol.
Lagerung
Bei 25 °C bis zu zwei Wochen, bei 4 °C bis zu drei Monaten und bei – 20 °C für 2 Wochen lagerfähig.
Empfehlung für die Beladung
- Tauen Sie den Marker entweder bei Raumtemperatur oder bei 37 – 40 °C für einige Minuten auf um präzipitierte Partikel zu lösen. Nicht kochen!
- Mischen Sie die Lösung gründlich um die Homogenität des Markers sicherzustellen.
- Beladen Sie das SDS-Polyacrylamidgel mit den folgenden Volumen des Markers:
- 5 µl pro Tasche für Minigele, 3 µl für Blots
- 10 µl pro Tasche für große Gele, 6 µl für Blots
FAQ
Welche Aminosäuren sind verlinked mit dem Proteinmarker MWP04?
Aminosäuren, die Amine als Seitenketten tragen, wie Arg oder Lys, sind an Farbreaktionen beteiligt.
Kann das Tryptophan mit Trihalo Komponenten der Bio-Rad Gele oder Fluoreszenzfarbstoffe reagieren?
Wir haben keine Daten bezüglich der Interaktion zwischen dem Marker MWP04 und Bio-Rad Gelen oder Fluoreszenzfarbstoffen.
Warum werden bei den Proteinmarkern die Molekulargewichte der Markerbanden für verschiedene Systeme getrennt angegeben?
Es gibt verschiedene Faktoren der Gel- und Pufferchemie, die einen Einfluss auf das Laufverhalten von Proteinen haben. Die wichtigsten sind:
- Migrationsrate: Die Migration von Proteinen in der Elektrophorese wird durch die Eigenschaften des Puffersystems beeinflusst, z. B. durch die Ionenstärke, den pH-Wert und das Vorhandensein bestimmter Ionen. Die verschiedenen Puffersysteme beeinflussen die elektrophoretische Mobilität von Proteinen unterschiedlich. Zum Beispiel können Proteine in einem Puffersystem schneller oder langsamer wandern als in einem anderen, was zu offensichtlichen Unterschieden in ihrem Molekulargewicht führt.
- Gel-Zusammensetzung: Die Art des Polyacrylamidgels und seine Porengröße können die Migration der Proteine beeinflussen. Verschiedene Puffersysteme können für unterschiedliche Geltypen optimiert sein, was sich darauf auswirkt, wie sich die Proteine durch die Gelmatrix bewegen. Diese Unterschiede können zu Abweichungen bei den beobachteten Molekulargewichten führen.
- pH-Wert: Der pH-Wert des Elektrophoresepuffers kann sich auch auf die Ladung und Konformation der Proteine auswirken, was wiederum ihre Wanderung im Gel beeinflusst. Verschiedene Puffersysteme können unterschiedliche pH-Werte haben, was zu Schwankungen bei der Schätzung des Molekulargewichts führt.
Tris-Glycin-Gele enthalten eine sich bewegende Front aus Cl- Ionen (von der Tris-HCl im Gel) und negativ geladenen Glycin-Ionen aus dem Laufpuffer. Die Glycin-Ionen bewegen sich langsamer als die Chlorid-Ionen durch das Sammelgel mit niedrigem pH-Wert (pH 6,8) und bilden eine schmale Zone, in der die Proteine konzentriert sind. Wenn die sich bewegende Front auf das Trenngel mit dem höheren pH-Wert (pH 8,8) trifft, bewegen sich die Glycin-Ionen schnell an den Chlorid-Ionen vorbei und ziehen dabei sozusagen die Proteine mit durch das Gel. Aufgrund dieser Zusammensetzung arbeiten Tris-Glycin-Gele im stark alkalischen Bereich und erreichen beim Laufen einen pH-Wert von bis zu 9,5.
Bis-Tris-Gele hingegen sind sauer und verwenden Chlorid als führendes Ion und entweder MOPS (3-[N-Morpholino]propansulfonsäure) oder MES (2-[N-Morpholino]ethansulfonsäure) als nachfolgendes Ion. MOPS wird für mittelgroße Proteine verwendet, während MES kleinere Proteine auflöst. Daher funktionieren Bis-Tris Gele bei neutralem pH.
Nur angemeldete Kunden können eine Bewertung abgeben.







Bewertungen
Es gibt noch keine Bewertungen.