Détails
MIDORI Green Advance est une alternative sûre à la coloration traditionnelle au bromure d’éthidium. C’est un colorant non cancérigène et moins mutagène pour détecter de l’ADNdb, de l’ADNsb et de l’ARN dans des gels d’agarose, et ce avec une très grande sensibilité. MIDORI Green Advance peut être utilisé avec une lumière UV ou avec notre technologie innovante à LED Bleu/Vert.
Alternative sûre au bromure d’éthidium
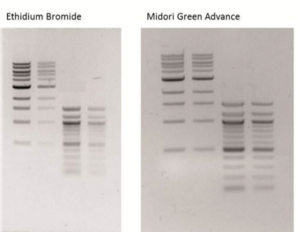
MIDORI Green Advance est un colorant non cancérigène de deuxième génération optimisé pour un signal plus lumineux lorsqu’il est excité par une lumière UV ou une lumière Bleue/Verte. Il garde les avantages d’être non cancérigène et d’avoir un excellent ratio signal/bruit de fond. Comme le montre la Fig. 1, MIDORIGreen Advance est meilleur que le bromure d’éthidium avec la technologie à LED bleu/vert.
MIDORI Green Advance montre une très grande sensibilité de détection, même pour des petits fragments d’ADN. Le facteur de dilution peut atteindre 1:25000. De ce fait, 4 à 6 μL seulement sont suffisant pour colorer 100 mL de gel d’agarose. Ce qui donne une possibilité de colorer entre 17 à 25 litres de gel d’agarose.

Fig. 1 : Comparaison de la sensibilité entre le colorant MIDORIGreen Advance (vert, partie gauche) et le bromure d’éthidium (rouge, partie droite) en utilisant un transilluminateur à UV.
Sécurité prouvée
Pour remplacer efficacement le bromure d’éthidium mutagène, il est essentiel que le signal fourni soit fort. MIDORI Green Advance produit des signaux d’une intensité comparable à ceux du bromure d’éthidium. Néanmoins, la sécurité de l’utilisateur ne doit pas être compromise. Par conséquent, plusieurs tests ont été effectués avec MIDORI Green Advance et, conformément à ces tests, MIDORI Green Advance est sûr.
- Ames-Test
- Acute Oral Toxicity Test
- Mouse Bone Marrow Micronucleus Test
- Chromosome Aberration Test
- Latex and Nitrile Gloves Penetration
Télécharger ici le rapport de sûreté de MIDORI Green Advance.
Retour clients
Retour client
Plus de 500 citations dans les journaux scientifiques !
MIDORIGreen Advance a été utilisé avec succès dans de nombreux laboratoires. Le retour d’experience a été très positif. Vous trouverez ci-dessous quelques résultats provenant de scientifiques indépendants :
Client #1
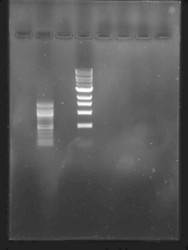
“…we have tested Midori Green Advance and we are very excited about it. Please find attached to this email a typical picture…”
Données aimablement fournies par
Dr. Olaf Voolstra,
Biosensor Research Group, Hohenheim University Stuttgart, Germany
Client #2

Bromure d’éthidium (gauche) en comparaison avec le MIDORIGreen Advance (droite) sur une table UV.
Données aimablement fournies par
Mr. Schuster,
Friedrich-Alexander-University Erlangen-Nürnberg, Germany
Client #3
Comparaison du bromure d’éthidium avec MIDORIGreen Advance sur une table UV.
Données aimablement fournies par
Ms. Abel,
Heinrich-Heine-University Düsseldorf, Germany
Échantillon gratuit
hbspt.forms.create({
region: “na1”,
portalId: “8262428”,
formId: “e78f1d3a-4281-4c7f-89a6-0923fa36b0ec”
});
Protocoles
In-gel staining
- Préparer 100 mL de solution de gel d’agarose (concentration comprise entre 0,8 et 3,0 %) et chauffer jusqu’à ce que la solution soit complètement transparente, sans petite particule flottante visible.
- Ajouter 4 – 6 µL de colorant ADN MIDORI Green Advanced à la solution de gel et mélanger doucement. Laisser refroidir à 50 – 60 °C et couler le gel dans le moule prévu. Quand le gel est solidifié, charger les échantillons et procéder à l’électrophorèse.
- Détecter les bandes en utilisant un illuminateur UV ou à LED. Des filtres de gélatine, ou de cellophane jaune ou vert devront être utilisés pour la photographie.
Poststaining
- La solution de colorant ADN poststaining MIDORI Green Advance peut être utilisée 2 ou 3 fois.
- Si la solution de coloration a pour but d’être réutilisée, elle doit être préférentiellement stockée dans le noir à température ambiante.
- Pour des gels d’agarose de < 0,5 cm d’épaisseur, 10 – 25 µL du colorant doit être utilisé pour 100 mL de tampon.
- Le temps de coloration optimal (5 – 60 minutes) et la quantité de colorant peuvent dépendre de l’épaisseur du gel.
REMARQUE : Il n’est pas recommandé d’utiliser la solution poststaining avec des tampons contenant du SDS, à cause de bandes parasites apparaissant par l’interaction de ces deux produits !
FAQ
Puis-je utiliser Midori Green Advance (MGA) pour une électrophorèse en champ pulsé (PFGE) ? Normallement je fais du poststaining avec de l’EtBr.
Un protocole de poststaining avec MGA est disponible dans la section protocole.
Avez-vous des détails sur l’élimination du MGA après utilisation ? Je comprends que la molécule est sensible à la lumière, je me demandais si le gel contenant du MGA pouvait être jeté après avoir été exposé à la lumière ?
MGA est non toxique, vous pouvez le jeter avec les déchets chimiques de laboratoire. L’émissivité du MGA sera détruite par la lumière, mais cela ne signifie pas que la structure chimique sera modifiée. Mais il n’est pas nécessaire de détruire la molécule car elle n’est en aucun cas nocive. C’est le gros avantage par rapport au bromure d’éthidium – qu’il n’y ai aucune élimination spécifique nécessaire.
Pourquoi MGA et MGD ne peuvent-ils pas être utilisés de la même manière ?
Les structures chimiques sont complètement différentes. Nous avons testé l’utilisation du Midori Green Direct (MGD) en tant que MGA et inversement, et nous ne pouvons pas recommander de les utiliser de la même manière. Lorsque vous essayez d’utiliser le MGD en tant que MGA, vous avez besoin de beaucoup de MGD et d’échelle ADN pour obtenir des bandes visibles. Les échantillons de faible concentration pourraient donc ne être détectés. Le MGD a été conçu pour être ajouté à l’échantillon et est beaucoup moins concentré que le MGA. Il n’est donc pas rentable d’utiliser le MGD à la place du MGA car vous aurez besoin d’une quantité 10 fois supérieure dans le gel pour pouvoir observer des bandes. Lorsque vous essayez d’utiliser le MGA en tant que MGD, cela pose également être problématique car le MGA est trop concentré et migre dans la direction opposée. J’ai essayé de réduire la concentration de MGA, mais dans ce cas vous ne voyez que quelques bandes qui sont très faibles, et ceci quelle que soit la dilution utilisée. En résumé, les deux colorants sont conçus (avec une formule structurelle différente) et optimisés pour différentes utilisations (in-gel et en l’ajoutant dans un échantillon) et il n’est pas recommandé d’essayer de les utiliser autrement.
Quelle est la différence entre le MGA et le MGD, et à quel point ces colorants sont-ils stables ?
La principale différence est que MGA est destiné aux utilisations in-gel et poststaining (donc utilisé comme le bromure d’éthidium) alors que MGD est ajouté directement à l’échantillon. En fonction du système de documentation, nous vous recommandons d’utiliser l’un ou l’autre, mais vous pouvez utiliser les deux pour chaque type d’illuminateur (UV 302, 365 nm, illuminateur à LED Bleue et transilluminateur à LED Bleu/Vert) – seul le rendement peut être augmenté à un niveau optimal. Par exemple, nous recommandons d’utiliser le MGA si l’utilisateur dispose d’un transilluminateur UV, car les résultats obtenus sont fantastiques avec ce colorant. Vous obtenez également une performance vraiment exceptionnelle avec nos instruments à LED Bleu/Vert et le MGD – pas de bruit de fond et un signal intense. Les deux colorants étant stables à température ambiante, leur expédition à température ambiante ne pose pas de problème, mais nous vous recommandons de les stocker à 4 °C.
Est-ce que le MGA et le MGD fonctionnent avec les gels d’agarose et d’acrylamide ?
Nos clients nous ayant fait des retours, il semblerait que le MGD et MGA (poststaining) fonctionnent avec des gels d’acrylamide mais ils ont initialement été conçus pour les gels d’agarose.
J’ai stocké le MGA à -20 °C pendant 6 jours, puis-je encore l’utiliser ?
La congélation détruit la fonctionnalité du MGA. Vous pouvez toujours essayer mais de notre expérience, le colorant perd de son illumination après congélation et vous risquez fortement de ne rien voir.
J’utilise le MGA en gels d’agarose, pourquoi les petites bandes sont invisibles quand je fais migrer le gel pendant 35 minutes et que recommandez-vous ?
Midori Green Advance est chargé positivement et migre dans la direction opposée de l’ADN, donc le gel se décolore par le bas. Pour voir des petites bandes vous pouvez réduire le temps de migration à 25 minutes. Si vous voulez un temps de migration plus long, vous pouvez faire du poststaining. Vous pouvez aussi utiliser la coloration in-gel et ensuite faire un peu de poststaining, ou vous pouvez uniquement utiliser le poststaining sans la coloration in-gel. Dans tous les cas, le gel sera coloré et vous pourrez observer les bandes de bas poids moléculaire. Vous pouvez également utiliser MGD au lieu de MGA. Ce colorant est ajouté à l’ADN, donc toutes les bandes seront colorées peu importe le temps de migration. Un autre avantage est l’absence de bruit de fond. particulièrement, si vous utiliser notre technologie de lumière LED Bleu/Vert à la place des UV, vous aurez des résultats incroyables.
Sur le fiche de données du Midori Green Advance, il est écrit que la solution de poststaining peut être utilisée 2 à 3 fois. Pendant combien de temps peut-on utiliser la solution de poststaining sans perdre trop de sensibilité ?
Nous avons effectivement des clients qui l’utilisent plus que 2-3 fois. Si le bain de coloration est à l’abri de la lumière tout le temps, vous pouvez l’utiliser 2-3 fois sans réduction de l’intensité du signal. Mais il est également possible de l’utiliser 5-8 fois sans perte d’intensité, dépendant de la taille du gel et de la quantité d’échantillons. Si vous détectez une perte d’intensité, vous pouvez ajouter un petit peu de MGA pour retrouver un signal aussi bon qu’avant.
Puis-je utiliser le MGA une fois la date d’expiration passée ?
Oui vous pouvez. La date d’expiration est juste la date limite où nous vous garantissons le produit, mais en général il dur beaucoup plus longtemps.
J’obtiens des bandes additionnelles après l’utilisation du MGA, est-ce normal ?
C’est possible si vous utilisez du SDS dans le tampon de charge.
Est-il possible d’utiliser Midori Green dans un gel de Polyacrylamide/Urée ?
Cela fonctionne très bien.
Est-ce que le Midori fonctionne avec des gels d’Urée/Formamide ?
Malheureusement cela ne fonctionne pas, à cause du Formamide. Les gels d’urée fonctionnent.
Le Midori Green contient-il du DMSO ?
Nos Midori Green ne contiennent pas de DMSO.
Puis-je utiliser des échelles ADN contenant de l’Orange G, du Bleu de bromophénol ou du Xylène cyanol FF avec MGA ?
Oui vous pouvez. Ils ne causent pas de problèmes, mis à part le Bleu de bromophénol qui peut réduire l’intensité du signal ou entrainer la formation de nuages dans le gel.
Puis-je ajouter MGA au tampon de migration pour réduire la décoloration du gel ? Si oui, quelle est la quantité que à ajouter ?
Oui vous pouvez ajouter MGA au tampon de migration, de l’ordre de 8 µL pour 100 mL de tampon.
Puis-je utiliser le MGA dans des expériences ultérieures, comme les southern blot ?
Nos clients nous rapportent que le colorant n’interfère pas avec les protocoles standards de Southern. Nous ne l’avons pas testé nous-même, comme il n’y a pas de signe d’une interférence du colorant avec la migration du gel ou sa documentation. Le seul problème (relié indirectement) est qu’aucune comparaison ne peut être établie entre des premières expériences de Southern-blots colorés in-gel (pendant l’électrophorèse) avec de l’EtBr et des expériences complémentaires utilisant du MGA, comme les pattern de migration des gels ne sont pas directement comparables entre ces deux colorants (si utilisés in-gel). Pour toute coloration post-migration et expériences ultérieurs, il n’y a pas de problème connu.
Le Midori Green Advance peut-il être utilisé en gels de Formaldéhyde dénaturants pour séparer l’ARN ?
Oui, il peut être utilisé.
Nous avons séparé de l’ARN total dans un gel 1 % Formaldéhyde avec du tampon TAE, avec les deux méthodes In-gel staining et poststaining. Dans chaque cas, 5 µL de MGA a été utilisé pour 100 mL de tampon. Le poststaining a été réalisé à température ambiante pendant 1 heure.
La concentration minimale d’ARN devrait être au moins de 250 ng par ligne. La concentration optimale de travail est de 500 ng.
Seuls les clients connectés peuvent laisser un avis.











Cynthia Geelen, KNAW, Netherlands Institute for Neuroscience –
I am amazed at how well Midori Green performs compared to Ethidium Bromide, which I have been using throughout my working career. The comparable results have made it an easy choice for me to switch to create a safer workplace.
Utilisateur vérifié
bob.kauffmann –
I (student) feel comfortable working with non-carcinogenic DNA staining products. The bands are also clearly visible.
Utilisateur vérifié
Rubén Arroyo, CINVESTAV –
Great signal for DNA, but rather weak for RNA (using formaldehyde-containing loading buffer), still not as good as EtBr.
Comment from Nippon Genetics:
Dear Mr Arroyo,
Many thanks for your feedback. I am glad to see that you were able to obtain very good results in staining DNA with MIDORI Green Advance. Regarding the results with RNA, I would like to suggest to you a publication from the year 2014:
Influence of trypsinization and alternative procedures for cell preparation before RNA extraction on RNA integrity.
The paper describes the use of MIDORI Green Advance for the staining of RNA separated using bleach RNA gels. Fig. 1-7 show agarose gels that were stained with MIDORI Green Advance.
An explanation for the difference that you experienced when comparing the signal of EtBr to MIDORI Green Advance could be due to the transilluminator used. We would like to invite you to see the signal of a gel you have prepared using our Blue/Green LED transilluminator or our FastGene UV-light table.
Best regards
Dr. Marcelo Lanz
Head of Product Management
Utilisateur vérifié
Physiologisches Institut, LMU –
Wir sind sehr zufrieden mit Midori Green Advance, perfekte alternative zur EtBr.
Translation by Nippon Genetics:
We are very happy with Midori Green Advance, which is a perfect alternative to EtBr.
Utilisateur vérifié
Dr Sandra Hoffmann, Institut für Humangenetik, Universität Heidelberg –
Midori Green Advance liefert sehr robuste Ergebnisse, welche absolut mit EtBr vergleichbar sind. Wir haben EtBr aus unseren Laboren mittlerweile vollständig durch Midori Green Advance, sowie Midori Green Direct ersetzt.
Translation by Nippon Genetics:
Midori Green Advance delivers very good results that are absolutely comparable to EtBr. We replace completely EtBr from our laboratories with Midori Green Advance and Midori Green Direct.
Utilisateur vérifié
Dr. Sturm, Applied Biosciences, KIT –
Absolutely the best alternative to EtBr. We changed many years ago from EtBr to Midori and since then, we never had any issues. Signals are as good as before and low toxicity works well with student environment.
Utilisateur vérifié
D. Tacke, Georg-August-University Göttingen, plant pathology and plant protection –
Wir verwenden Midori Green Advance seit 2014 in unserer Abteilung und sind sehr zufrieden damit. Sowohl im täglichen Laboralltag als auch in Studentenpraktika liefert der Farbstoff sehr gute Ergebnisse.
Translated by Nippon Genetics:
We use Midori Green Advance in our department since 2014 and are very satisfied with it. In everyday laboratory practice as well as in practical course for students the stain delivers very good results.
Utilisateur vérifié
Dr. Olaf Voolstra von der Universität Hohenheim, Fg. Biosensorik aus Stuttgart –
„…haben wir das Midori Green Advance getestet und sind begeistert!… ”
Translated by Nippon Genetics:
“…we have tested Midori Green Advance and we are very excited about it….”
Utilisateur vérifié